Gerelateerde onderwerpen
Inleiding
Dementie is een chronische, globale, meestal irreversibele verslechtering van cognitie. De diagnose is klinisch; laboratorium- en beeldvormingtests worden gebruikt om behandelbare oorzaken te identificeren. De behandeling is ondersteunend. Cholinesteraseremmers kunnen soms tijdelijk de cognitieve functie verbeteren. Dementie kan optreden op elke leeftijd maar beïnvloedt vooral ouderen (ongeveer 5% van de ouderen tussen de 65 en 74, en 40% van de ouderen > 85). Het is goed voor meer dan de helft van de verpleeghuisopnamen. Tenminste 5 miljoen mensen in de VS hebben dementie.
Dementieën kunnen op verschillende manieren worden geclassificeerd:
- Alzheimer’s of non-Alzheimer’s type
- Corticaal of subcorticaal
- Irreversibel of potentieel reversibel
- Normaal of zeldzaam
Oorzaken
Dementie kunnen het gevolg zijn van hersenziekten of andere omstandigheden (zie Tabel 1). De meest voorkomende typen van dementie zijn de ziekte van Alzheimer, vasculaire dementie, Lewy body dementie, frontotemporale dementieën en HIV-geassocieerde dementie. Dementie komt ook voor bij patiënten met de ziekte van Parkinson, de ziekte van Huntington, progressieve supranucleaire palsy, de ziekte van Creutzfeldt-Jakob, het Gerstmann-Sträussler-Scheinker syndroom, andere prion-aandoeningen en neurosyfilis. Patiënten kunnen > 1 type hebben (gemengde dementie). Sommige structurele hersenaandoeningen (bijv. normale-druk hydrocephalus, subduraal hematoom), metabole aandoeningen (bijv. hypothyroïdisme, vitamine B12 deficiëntie), en toxinen (bijv. lood) veroorzaken een langzame verslechtering van de cognitie, die kan oplossen met behandeling. Deze beperking wordt soms reversibele dementie genoemd, maar sommige experts beperken de term dementie tot irreversibele cognitieve achteruitgang. Een depressie kan dementie nabootsen (en werd voorheen pseudodementie genoemd); de 2 aandoeningen co-existeren vaak. Echter, depressie kan de eerste manifestatie zijn van dementie.
|
Symptomen
Dementie tast de cognitie globaal aan. Het begin is geleidelijk, hoewel familieleden plotseling tekorten kunnen opmerken (bijv. wanneer het functioneren wordt aangetast). Vaak, is het verlies van kortetermijn geheugen het eerste signaal. Hoewel de symptomen bestaan in een continuüm, kunnen ze worden onderverdeeld in vroege, intermediaire, en late symptomen. Persoonlijkheidsveranderingen en gedragsstoornissen kunnen zich vroeg of laat ontwikkelen. Motorische en andere focale neurologische tekorten treden op in verschillende fases, afhankelijk van het type dementie; ze doen zich vroeg voor bij vasculaire dementie en laat bij de ziekte van Alzheimer. De incidentie van aanvallen is iets verhoogd gedurende alle stadia. Psychose - hallucinaties, delusies, of paranoia - komt voor bij ongeveer 10% van de patiënten met dementie, hoewel een hoger percentage deze symptomen tijdelijk kan ervaren.
Vroeg: het recente geheugen is aangetast; het leren en onthouden van nieuwe informatie wordt moeilijk. Taalproblemen (vooral met het vinden van woorden), stemmingswisselingen, en persoonlijkheidsveranderingen ontwikkelen zich. Patiënten kunnen progressieve moeilijkheden hebben met onafhankelijke activiteiten van het dagelijks leven (bijv. balancing their checkbook, de weg vinden, herinneren waar ze dingen gezet hebben). Het abstract denken, inzicht, of de beoordeling kan aangetast zijn. Patiënten kunnen reageren op het verlies van onafhankelijkheid en geheugen door prikkelbaarheid, vijandigheid, en agitatie. Het functionele vermogen kan verder beperkt zijn door het volgende:
- Agnosie: beperkt vermogen om objecten e identificeren ondanks intacte sensorische functie.
- Apraxie: beperkt vermogen om eerder geleerde motorische activiteiten uit te voeren ondanks intacte motorische functie
- Afasie: beperkt vermogen om taal te begrijpen of gebruiken.
Hoewel vroege dementie de sociabiliteit niet hoeft te compromitteren, kunnen familieleden vreemd gedrag rapporteren gepaard gaand met emotionele labiliteit.
Intermediair: Patiënten zijn steeds minder in staat te leren en zich nieuwe informatie te herinneren. Het geheugen van verre gebeurtenissen is verminderd maar niet totaal verloren. Patiënten kunnen hulp nodig hebben bij basisactiviteiten uit het dagelijks leven (bijv. baden, eten, aankleden, naar het toilet gaan). Persoonlijkheidsveranderingen kunnen progresseren. Patiënten kunnen prikkelbaar, angstig, egocentrisch, inflexibel, of sneller boos worden, of ze kunnen passiever worden, met een vlak affect, depressie, besluiteloosheid, gebrek aan spontaniteit, of algemene terugtrekking uit sociale situaties. Gedragstoornissen kunnen zich ontwikkelen: Patiënten kunnen rondzwerven of plotseling en ongepast geagiteerd, vijandig, oncoöperatief, of fysiek agressief worden. In dit stadium zijn de patiënten alle gevoel van tijd en plaats verloren omdat ze normale omgevings- en sociale aanwijzingen niet effectief kunnen gebruiken. Patiënten verdwalen vaak; ze kunnen niet in staat zijn hun eigen slaapkamer of badkamer te vinden. Ze blijven ambulant maar hebben risico op vallen of ongelukken secundair aan verwarring. Een veranderende sensatie of perceptie kan resulteren in psychose met hallucinaties en paranoïde en achtervolgingswanen. De slaappatronen zijn vaak ongeorganiseerd.
Laat (ernstig): Patiënten kunnen niet lopen, zichzelf voeden, of andere dagelijkse activiteiten doen; ze kunnen incontinent worden. Het recente en verre geheugen is volledig verloren. Patiënten kunnen niet in staat zijn te slikken. Ze hebben risico op ondervoeding, pneumonie (vooral vanwege aspiratie), en drukzweren. Omdat zij voor zorg volledig van anderen afhankelijk zijn, wordt plaatsing in een lange-termijn zorginstelling vaak noodzakelijk. Uiteindelijk worden de patiënten stom. Omdat dergelijke patiënten de symptomen niet kunnen beschrijven tegen een arts en omdat oudere patiënten vaak geen febriele of leukocytische respons hebben op infectie, moet een arts vertrouwen op ervaring en inzicht wanneer een patiënt ziek lijkt. Eindstadium dementie resulteert in coma en overlijden, meestal vanwege infectie.
Diagnose
- Differentiatie van delirium van dementie, hoofdzakelijk door onderzoek naar de mentale status.
- Identificatie van behandelbare oorzaken, klinische en door laboratoriumtests en neurobeeldvorming.
- Soms formeel neuropsychologisch testen
Het onderscheiden van het type of de oorzaak van dementie kan moeilijk zijn; de definitieve diagnose vereist vaak postmortem pathologisch onderzoek van het hersenweefsel. De klinische diagnose richt zich dus op het onderscheiden van dementie van delirium en andere aandoeningen, en het identificeren van de aangetaste cerebrale gebieden en potentieel reversibele oorzaken.
Dementie moet onderscheiden worden van de volgende zaken:
- Delirium: Onderscheid maken tussen dementie en delirium is cruciaal (omdat delirium vaak reversibel is met een snelle behandeling) maar kan moeilijk zijn. Aandacht wordt als eerst beoordeeld. Als een patiënt onoplettend is, is de diagnose waarschijnlijk delirium, hoewel gevorderde dementie de aandacht ook ernstig beperkt. Andere eigenschappen die eerder duiden op delirium dan op dementie (bijv. duur van de cognitieve beperking) worden bepaald door de geschiedenis, lichamelijk onderzoek, en tests voor specifieke oorzaken.
- Leeftijdgeassocieerde geheugenbeperking: Deze beperking is niet ernstig genoeg om het dagelijks functioneren te beïnvloeden. Als de getroffen mensen genoeg tijd wordt gegeven om nieuwe informatie te leren, is hun intellectuele prestatie goed.
- Milde cognitieve beperking: Het geheugen is beperkt, mar andere cognitieve gebieden en het dagelijks functioneren zijn niet aangetast.
- Dementie of depressie: Deze cognitieve stoornis verdwijnt met behandeling van depressie. Depressieve oudere patiënten kunnen cognitieve achteruitgang ervaren, maar in tegenstelling tot patiënten met dementie, hebben ze de neiging om hun geheugenverlies te overdrijven en vergeten ze zelden belangrijke actuele gebeurtenissen of persoonlijke zaken. Neurologische onderzoeken zijn normaal behalve signalen van psychomotorische vertraging. Wanneer ze getest worden, doen patiënten met depressie weinig moeite om te reageren, maar die met dementie proberen hard, maar reageren onjuist. Wanneer depressie en dementie co-existeren, herstelt behandeling van de depressie de cognitie niet volledig.
Klinische criteria: de beste test voor dementie is een test van het korte-termijngeheugen (bijv. 3 voorwerpen in zich opnemen en deze herinneren na 5 minuten); patiënten met dementie vergeten makkelijk informatie binnen 3 tot 5 minuten. Een ander test beoordeelt het vermogen om objecten in te delen in categorieën (bijv. een lijst van dieren, planten, of meubelstukken). Patiënten met dementie hebben veel moeite er enkele te noemen; patiënten zonder dementie noemen er met gemak veel.
Naast het verlies van het korte-termijgeheugen, vereist de diagnose van dementie tenminste een van de volgende cognitieve tekorten:
- Afasie
- Apraxie
- Agnosie
- Beperkt vermogen om te plannen, organiseren, volgorde aan te brengen, of abstract te denken (uitvoerende dysfunctie)
Elk cognitief tekort moet de functie substantieel beperken en een significante daling van een vorig niveau van functioneren representeren. Ook moeten de tekorten niet slechts optreden tijdens delirium. Een formeel onderzoek van de mentale status dient te worden gedaan. De Mini-Mental Status Examination wordt vaak gebruikt. Wanneer delirium afwezig is, duidt de aanwezigheid van meerdere tekorten, vooral bij patiënten met een gemiddeld of hoog niveau van educatie, op dementie. Geschiedenis en lichamelijk onderzoek moeten zich dan richten op behandelbare aandoeningen die een cognitiev beperking veroorzaken. (bijv. vitamine B12 deficiëntie, neurosyfilis, hypothyroïdisme, depressie).
Laboratoriumonderzoek: Tests moeten metingen van thyroïdstimulerend hormoon- en vitamine B12 niveau’s omvatten. Routine CBC en leverfunctietests worden soms aangeraden, maar het rendement is erg laag. Als klinische bevindingen wijzen op een specifieke aandoening, zijn andere tests (bijv. voor HIV of syfilis) geïndiceerd. Een lumbaalpunctie is zelden nodig maar dient te worden overwogen als een chronische infectie of neurosyfilis wordt verdacht. Andere tests kunnen gebruikt worden om oorzaken van delirium uit te sluiten.
Neurobeelvorming: CT of MRI moet worden gedaan in de initiële evaluatie van dementie of na een plotselinge verandering in cognitie of mentale status. Neurobeeldvorming kan potentieel reversibele structurele aandoeningen (bijv. normale-druk hydrocefalie, hersentumoren, subduraal hematoom) en andere metabole aandoeningen (bijv. de ziekte van Hallervorden-Spatz, de ziekte van Wilson) identificeren. Soms is EEG nuttig (bijv. om episodisch verloop van aandacht of bizar gedrag te evalueren). Functionele MRI of single-foton emissie CT kan informatie verschaffen over de cerebrale perfusiepatronen en helpen met de differentiële diagnose (bijv. bij het differentiëren van de ziekte van Alzheimer van frontotemporale dementie en Lewy-lichaam dementie.
Neuropsychologische onderzoeken: Als de diagnose twijfelachtig blijft, moeten patiënten worden doorverwezen voor formeel neuropsychologisch testen, wat zowel de stemming als de mentale functies evalueert, en 1 tot 3 uur duurt. Het wordt gedaan of begeleid door een neuropsycholoog. Dergelijk testen helpt vooral bij de differentiatie van het volgende:
- Leeftijdgeassocieerde geheugenbeperking, milde cognitieve beperking, en dementie, vooral wanneer de cognitie slechts licht is aangetast of wanneer de patiënt of familieleden bang zijn voor de reassurance.
- Dementie en focale syndromen van een cognitieve stoornis (bijv. amnesie, afasie, apraxie, visuospatiële problemen) wanneer het onderscheid niet klinisch evident is.
Prognose
Dementie is vaak progressief. De mate van progressie varieert echter sterk en is afhankelijk van de oorzaak. Dementie verkort de levensverwachting, maar de overlevingsprognoses variëren.
Behandeling
Maatregelen om de veiligheid van de patiënt te garanderen en een passende omgeving te bieden zijn essentieel voor de behandeling, net als hulp voor de zorgverlener. Verschillende geneesmiddelen zijn beschikbaar.
Veiligheid van de patiënt: Occupational- en fysiotherapeuten kunnen de veiligheid van het huis evalueren; de doelen zijn ongelukken te voorkomen (vooral vallen), gedragsstoornissen te beheersen, en veranderingen te plannen als de dementie progresseert.
Met behulp van simulaties dient te worden geëvalueerd hoe goed patiënten functioneren in verschillende settings (bijv. keuken, auto). Als patiënten tekorten hebben en in dezelfde omgeving blijven, kunnen beschermende maatregelen (bijv. het verstoppen van messen, de auto weghalen, autosleutels in beslag nemen) nodig zijn. Sommige staten vragen artsen om het Department of Motor Vehicles in kennis te stellen van patiënten met dementie, omdat deze patiënten op een bepaald punt niet langer veilig kunnen rijden. Als patiënten zwerven, kunnen signaalcontrole systemen worden geïnstalleerd, of patiënten kunnen worden geregistreerd in het Safe Return-programma. Er is informatie beschikbaar van de Alzheimer's Association. Uiteindelijk kan bijstand (bijv. huishoudster, home health aides) of een verandering van omgeving (woonfaciliteiten zonder trappen, assisted-living facility, skilled nursing facility) geïndiceerd zijn.
Omgevingsmaatregelen: Patiënten met lichte tot matige dementie functioneren meestal het best in een vertrouwde omgeving. Of het nu thuis is of in een instelling, de omgeving moet ontworpen zijn om gevoelens van zelfbeheersing en persoonlijke waardigheid te helpen bewaren, door het volgende verschaffen:
- Regelmatige versterking van de oriëntatie
- Een heldere, vrolijke, vertrouwde omgeving
- Minimale nieuwe stimulatie
- Regelmatige low-stress activiteiten
Grote kalenders en klokken en een routine voor dagelijkse activiteiten kan helpen bij de oriëntatie; medische personeelsleden kunnen grote naamplaatjes dragen en zichzelf herhaaldelijk voorstellen. Veranderingen in omgeving, routines, of mensen moeten nauwkeurig en eenvoudig worden uitgelegd aan patiënten, waarbij niet-essentiële procedures worden weggelaten. Patiënten hebben tijd nodig om zich aan te passen aan en vertrouwd te raken met de veranderingen. Aan patiënten vertellen wat er gaat gebeuren (bijv. over een bad of voeding) kan weerstand of gewelddadige reacties afwenden. Regelmatige bezoekjes door stafleden en bekenden stimuleren patiënten sociaal te blijven.
De kamer dient redelijk helder te zijn en sensorische stimuli te bevatten (bijv. radio, televisie, nachtlicht) om patiënten te helpen georiënteerd te blijven en hun aandacht te richten. Rustige, donkere, privékamers moeten worden vermeden. Activiteiten kunnen patiënten helpen beter te functioneren; activiteiten die gerelateerd zijn aan interesses voor de dementie begon zijn goede keuzes. De activiteiten moeten aangenaam zijn, enige stimulatie bieden, maar niet te veel keuzes of uitdagingen bevatten. Dagelijks moeten oefeningen worden gedaan om rusteloosheid te verminderen, het evenwicht te verbeteren, en de cardiovasculaire toon te behouden. Oefening kan ook helpen de slaap te verbeteren en gedragsstoornissen te beheersen. Occupational- en muziektherapie helpt de fijne motorische controle te behouden en geeft non-verbale stimulatie. Groepstherapie (bijv. reminiscentietherapie, socialisatieactiviteiten) kunnen helpen de conversationele- en inter-persoonlijke vaardigheden te behouden.
Geneesmiddelen: Het stoppen met of beperken van geneesmiddelen met CZS-activiteit verbetert vaak de functie. Sederende en anticholinerge geneesmiddelen, die de neiging hebben dementie te verslechteren, moeten worden vermeden. De cholinesteraseremmers donepezil, rivastigmine en galantamine zijn enigszins effectief bij het verbeteren van de cognitieve functie bij patiënten met de ziekte van Alzheimer of Lewy-lichaam dementie en kunnen nuttig zijn bij andere vormen van dementie. Deze geneesmiddelen remmen acetylcholinesterase, waardoor het acetylcholineniveau in de hersenen toeneemt.
Memantine, een NMDA (N-methyl-d-aspartaat) antagonist, kan helpen de progressie van matige tot ernstige dementie te vertragen en kan worden gebruikt met een cholinesteraseremmer. Andere geneesmiddelen (bijv. antipsychotica) zijn gebruikt om gedragsstoornissen te beheersen. Patiënten met dementie en signalen van een depressie moeten worden behandeld met non-anticholinerge antidepressiva, bij voorkeur SSRI’s.
Bijstand verzorger: Directe familieleden zijn grotendeels verantwoordelijk voor de zorg van een patiënt met dementie. Verpleegkundigen en sociaal werkers kunnen hen en andere verzorgers leren hoe ze het beste kunnen voldoen aan de behoeften van de patiënt (bijv. hoe om te gaan met de dagelijkse verzorging en financiële kwesties); het onderwijzen moet ongoing zijn. Andere bronnen (bijv. steungroepen, educatief materiaal, websites) zijn beschikbaar. Verzorgers kunnen een behoorlijke stress ervaren. Stress kan worden veroorzaakt door zorgen over de bescherming van de patiënt en door frustratie, uitputting, woede, wrok om zoveel te moeten doen om voor iemand te zorgen. Zorgverleners moeten oppassen voor vroege symptomen van stress en burnout van de verzorger, en wanneer nodig, ondersteunende diensten suggereren (bijv. sociaal werker, diëtist, verpleegkundige, home health aide). Als een patiënt met dementie een ongewone verwonding heeft, moet de mogelijkheid van ouderenmishandeling worden onderzocht.
End-of-life kwesties: Omdat inzicht en beoordeling verslechteren bij patiënten met dementie, kan benoeming van een familielid, voogd, of advocaat om toezicht te houden op de financiën noodzakelijk zijn. Vroeg in dementie, voordat de patiënt incapacitated wordt, moeten de wensen van de patiënt voor wat betreft zorg verduidelijkt worden, en er moeten financiële en wettelijke afspraken (bijv. betrouwbare volmacht, betrouwbare volmacht voor gezondheidszorg) worden gemaakt. Wanneer deze documenten ondertekend zijn, moet de capaciteit van de patiënt worden geëvalueerd en de resultaten moeten worden vastgelegd. Beslissingen over kunstmatige voeding en behandeling van acute stoornissen kunnen het best worden gemaakt voordat de noodzaak er is. Bij gevorderde dementie kunnen palliatieve maatregelen meer geschikt zijn dan zeer agressieve interventies of ziekenhuiszorg.
ADDENDUM
1. DE ZIEKTE VAN ALZHEIMER
Inleiding
De ziekte van Alzheimer veroorzaakt een progressieve cognitieve achteruitgang en wordt gekenmerkt door seniele plaques, β-amyloïd afzettingen, en neurofibrillaire tangles in de cerebrale cortex en subcorticale grijze stof. De ziekte van Alzheimer is de meest voorkomende oorzaak van dementie; het neemt >65% van alle dementiegevallen bij ouderen voor z’n rekening. De ziekte komt twee keer zo vaak voor bij vrouwen als bij mannen, deels omdat vrouwen een langere levensverwachting hebben. De ziekte van Alzheimer treft ongeveer 4% van de mensen tussen de 65 en 74 en 30% van de mensen >85 jaar. De prevalentie in geïndustrialiseerde landen zal naar verwachting toenemen als de proportie ouderen toeneemt.
Etiologie
De meeste gevallen zijn sporadisch, met late aanvang (≥ 60 jaar) en een onduidelijke etiologie. Echter, ongeveer 5 tot 15% is familiaal; ½ van deze gevallen heeft een vroege (preseniele) aanvang (<60 jaar) en is meestal gerelateerd aan specifieke genetische mutaties. Tenminste 5 verschillende genetische loci, gelegen op de chromosomen 1, 12, 14, 19, en 21, beïnvloeden de initiatie en progressie van de ziekte va Alzheimer. Mutaties in genen voor het amyloïd precursor eiwit, preseniline I, en preseniline II kunnen leiden tot autosomaal dominante vormen van de ziekte van Alzheimer, meestal met preseniele aanvang. Bij getroffen patiënten, is de verwerking van het amyloïd precursor eiwit veranderd, wat leidt tot depositie en fibrillaire aggregatie van β-amyloïd. β-amyloïd kan leiden tot neuronale dood en formatie van neurofibrillaire tangles en seniele plaques, welke bestaan uit gedegenereerde axonale of dendritische uitlopers, astrocyten, en gliacellen rond een amyloïdkern. Andere genetische determinanten omvatten apolipoproteïne (apo) E allelen (ε). Apo E proteïnen beïnvloeden de β-amyloïd afzetting, de cytoskeletale integriteit, en de efficiëntie van neuronaal herstel. Het risico op de ziekte van Alzheimer is aanzienlijk verhoogd bij mensen met 2 ε4 allelen en kan verminderd zijn bij mensen die het ε2 allel hebben. Varianten in SORL1 kunnen ook betrokken zijn; ze komen meer voor bij mensen bij wie de ziekte van Alzheimer een late aanvang heeft. Deze varianten kunnen zorgen dat het gen slecht gaat functioneren, wat mogelijk resulteert in een verhoogde productie van β-amyloïd. De relatie van andere factoren (bijv. lage hormoonniveaus, blootstelling aan metaal) met de ziekte van Alzheimer wordt onderzocht, maar er zijn nog geen definitieve oorzakelijke verbanden vastgesteld.
Pathofysiologie
Meestal ontwikkelen zich extracellulaire β-amyloïd afzettingen, intracellulaire neurofibrillaire tangles (gepaarde helische filamenten), en seniele plaques, en neuronen gaan verloren. Cerebrocorticale atrofie komt vaak voor, en het gebruik van cerebrale glucose wordt verminderd, net als de perfusie in de pariëtale lob, temporale cortices, en de prefrontale cortex. Andere vaak voorkomende afwijkingen omvatten verhoogde concentraties van het tau-proteïne (een component van neurofibrillaire tangles en β-amyloïd) in de hersenen en CSF, en verlaagde niveaus van choline acetyltransferase en verschillende neurotransmitters (bijv. somatostatine).
Symptomen
De symptomen en signalen van de ziekte van Alzheimer zijn vergelijkbaar met die van andere dementieën, met vroege, intermediaire, en late stadia. Verlies van het korte-termjjngeheugen is vaak het eerste signaal. Cognitieve tekorten neigen meerdere functies te betrekken. De ziekte progresseert geleidelijk maar kan plateau gedurende perioden. Gedragsstoornissen (bijv. zwerven, agitatie, schreeuwen, ideatie van achtervolging) komen vaak voor.
Diagnose
Over het algemeen is de diagnose vergelijkbaar met die van andere dementieën. Klinische criteria (waaronder een grondige geschiedenis en standaard neurologisch onderzoek) zijn 85% accuraat bij de vaststelling van de diagnose en het onderscheiden van de ziekte van Alzheimer van andere vormen van dementie, zoals vasculaire dementie en Lewy-lichaam dementie. Traditionele diagnostische criteria voor de ziekte van Alzheimer omvatten alle van de volgende:
- Dementie klinisch vastgesteld en gedocumenteerd door een officieel onderzoek van de mentale status
- Tekorten in ≥ 2 cognitiegebieden
- Geleidelijke aanvang en progressieve verslechtering van het geheugen en andere cognitieve functies
- Geen verstoring van het bewustzijn
- Aanvang boven de leeftijd van 40, meestal boven de leeftijd van 65
- Geen systemische hersenaandoeningen die verantwoordelijk zouden kunnen zijn voor de progressieve tekorten in het geheugen en de cognitie
Echter, deviaties van deze criteria sluiten een diagnose van de ziekte van Alzheimer niet uit, vooral omdat patiënten gemengde dementie kunnen hebben.
Differentieel diagnose
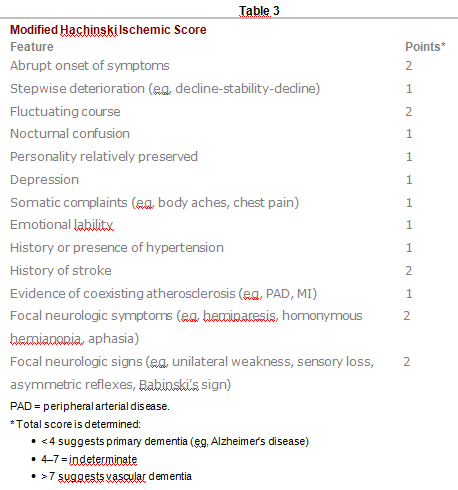
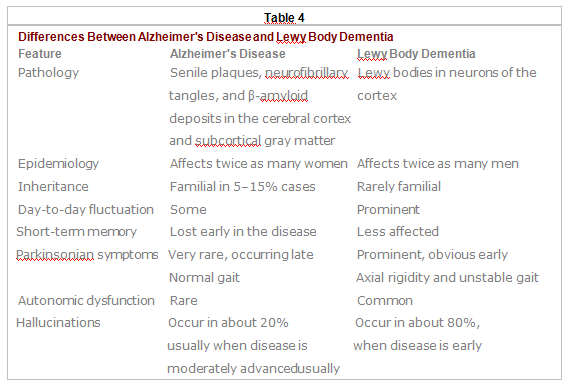
Het onderscheiden van de ziekte van Alzheimer ban andere dementieën is moeilijk. Beoordelingsmethoden (bijv. Ischemische Score van Hachinski —zie Tabel 3) kunnen helpen vasculaire dementie te onderscheiden van de ziekte van Alzheimer. Fluctuaties in cognitie, parkinsoniaanse symptomen, goed gevormde visuele hallucinaties, en relatief behoud van het korte-termijngeheugen duiden eerder op Lewy-lichaam dementie dan op de ziekte van Alzheimer (zie Tabel 4). Patiënten met de ziekte van Alzheimer zijn vaak beter verzorgd en netter dan patiënten met andere dementieën.
Prognose
Hoewel de progressiesnelheden variëren, is cognitieve achteruitgang onvermijdelijk. De gemiddelde overleving vanaf het moment van diagnose is 7 jaar, hoewel er over dit getal gediscussieerd wordt. De gemiddelde overleving vanaf het moment dat patiënten niet meer kunnen lopen is ongeveer 6 maanden.
Behandeling
De algemene behandeling is hetzelfde als die van alle dementieën.
Cholinesteraseremmers verbeteren bescheiden de cognitieve functie en het geheugen bij sommige patiënten. Er zijn er vier beschikbaar: over het algemeen zijn donepezil, rivastigmine en galantamine even effectief, maar tacrine wordt zelden gebruikt vanwege zijn hepatotoxiciteit. Donepezil is een eerstelijns geneesmiddel omdat het een eenmaal/dag dosering heeft en goed getolereerd wordt. De aanbevolen dosis is 5 mg eenmaal daags gedurende 4 tot 6 weken, vervolgens verhoogd tot 10 mg eenmaal daags. De behandeling moet worden voortgezet als de functionele verbetering zichtbaar is na enkele maanden, maar anders moet worden gestopt. De meest voorkomende bijwerkingen zijn GI (bijv. nausea, diarree). Zelden treden duizeligheid en hartritmestoornissen op. De bijwerkingen kunnen worden gereduceerd door de dosis geleidelijk te verhogen.
Memantine, een N-methyl-d-aspartaat receptor antagonist, lijkt de progressie van de ziekte van Alzheimer te vertragen. De dosis is 5 mg po eenmaal daags, welke wordt verhoogd tot 10 mg po bid gedurende ongeveer 4 weken. Voor patiënten met renale insufficiëntie, moet de dosis verlaagd worden of het geneesmiddel moet worden vermeden. Memantine kan gebruikt worden met een cholinesteraseremmer. De werkzaamheid van hoge-dosis vitamine E (1000 IE po eenmaal daags of bid), selegiline, NSAID’s, Ginkgo biloba extracten, en statinen is onduidelijk. Oestrogeentherapie lijkt niet nuttig te zijn bij de preventie of behandeling en kan schadelijk zijn.
Preventie
Vooraf, observationeel bewijs suggereert dat het risico op de ziekte van Alzheimer kan worden verminderd door het volgende:
- Het blijven doen van uitdagende mentale activiteiten (bijv. nieuwe vaardigheden leren, kruiswoordpuzzels maken) tot op hoge leeftijd]
- Lichaamsbeweging
- Beheersen van hypertensie
- Verlagen van het cholesterolgehalte
- Consumeren van een dieet rijk aan ω-3 vetzuren en arm aan verzadigde vetten
- Het drinken van alcohol in bescheiden hoeveelheden. Echter, er is geen overtuigend bewijs dat mensen die geen alcohol drinken hiermee moeten beginnen om de ziekte van Alzheimer te voorkomen.
2. VASCULAIRE DEMENTIE
Inleiding
Vasculaire dementie is acute of chronische cognitieve achteruitgang als gevolg van diffuse of focale cerebrale infarctie die het vaakst is gerelateerd aan een cerebrovasculaire ziekte. Vasculaire dementie is de 2e meest voorkomende oorzaak van dementie bij ouderen. Het komt meer voor bij mannen en begint meestal na de leeftijd van 70. Het treedt vaker op bij mensen die vasculaire risicofactoren hebben (bijv. hypertensie, diabetes mellitus, hyperlipidemie, roken) en bij mensen die meerdere beroertes hebben gehad. Veel mensen hebben zowel vasculaire dementie als de ziekte van Alzheimer.
Vasculaire dementie treedt op wanneer meerdere kleien cerebrale infarcten (of soms bloedingen) genoeg neuronaal of axonaal verlies veroorzaken om de hersenfunctie aan te tasten. Vasculaire dementieën omvatten de volgende:
- Lacunaire ziekte: Kleine bloedvaten worden aangetast.
- Multi-infarct dementie: Middelgrote bloedvaten zijn aangetast.
- Strategische enkel-infarct dementie: een enkel infarct treedt op in een cruciaal hersengebied (bijv. angulaire gyrus, thalamus).
- Binswangerdementie (subcorticale arteriosclerotische encephalopathie): Deze ongebruikelijke variant van small-vessel dementie wordt geassocieerd met ernstige, slecht gecontroleerde hypertensie en systemische vasculaire ziekte. Het betrekt meerdere lacunaire infarcten in de diepe hemisferische witte en grijze stof.
Symptomen
De symptomen en signalen zijn vergelijkbaar met die van andere dementieën. Echter, omdat infarctie de oorzaak is, neigt vasculaire dementie te progresseren in discrete stappen; elke episode wordt vergezeld door intellectuele achteruitgang, soms gevolgd door een bescheiden herstel. Als de ziekte progresseert, ontwikkelen zich vaak focale neurologische tekorten:
- Overdrijving van diepe peesreflexen
- Extensor plantair respons
- Afwijkingen in het lopen
- Zwakheid van een extremiteit
- Hemiplegieën
- Pseudobulbaire palsy met pathologisch lachen en huilen
- Andere signalen van extrapiramidale dysfunctie
Echter, omdat ischemische schade aan een klein vat neigt kleine, oplopende tekorten te veroorzaken, lijkt de achteruitgang geleidelijk. Het cognitief verlies kan focaal zijn. Bijvoorbeeld, het korte-termijngeheugen kan minder aangetast zijn dan bij andere dementieën. Patiënten met partiële afasie kunnen zich meer bewust zijn van hun tekorten; depressie kan hier dus ook vaker voorkomen dan bij andere dementieën.
Diagnose
De diagnose is vergelijkbaar met die van andere dementieën. Als er focale signalen of bewijs van een cerebrovasulaire aandoening aanwezig is, dient een grondige evaluatie voor een beroerte te worden gedaan (zie CVA). CT en MRI kunnen bilaterale veelvoudige infarcten in de dominante hemisfeer en limbische structuren laten zien, verscheidene lacunaire beroertes, of periventriculaire witte stof lesies die zich tot in de diepe witte stof uitbreiden. Bij Binswangerdementie laat beeldvorming meerdere lacunae zien die structuren diep in de grijze stof aantasten (bijv. basale ganglia, thalamische nuclei). De Ischemische Score van Hachinski wordt soms gebruikt om vasculaire dementie te onderscheiden van de ziekte van Alzheimer (zie Tabel 1).
Prognose
De 5-jaar-mortaliteit is 61%, wat hoger is dan die voor de meeste vormen van dementie, vermoedelijk omdat andere artherosclerotische aandoeningen co-existeren.
Behandeling
Over het algemeen is de behandeling hetzelfde als die voor andere dementieën. Echter, vasculaire dementie kan voorkomen worden, en de progressie kan worden vertraagd door bloeddrukbeheersing, cholesterolverlagende therapie, regulatie van plasmaglucose (90 tot 150 mg/dL), en stoppen met roken. De werkzaamheid van cholinesteraseremmers en memantine is twijfelachtig. Echter, omdat veel patiënten ook de ziekte van Alzheimer hebben, kunnen deze geneesmiddelen enkele voordelen hebben. Adjunctieve geneesmiddelen voor depressie, psychose, en slaapstoornissen zijn nuttig.
3. LEW BODY DEMENTIE
Inleiding
Lewy-lichaam dementie is chronische cognitieve achteruitgang gekenmerkt door cellulaire inclusies genaamd Lewy-lichamen in het cytoplasma van de corticale neuronen. Lewy-lichaam dementie is de 3e meest voorkomende dementie. De leeftijd van aanvang is meestal >60. Lewy-lichamen zijn sferische, eosinfiele, neuronale cytoplasmatische inclusies bastaande uit aggregaten van α-synucleïne, een synaptisch eiwit. Ze komen voor in de cortex van sommige patiënten met primaire Lewy-lichaam dementie. De neurotransmitterniveaus en neuronale routes tussen het stiatum en de neocortex zijn abnormaal. Lewy-lichamen komen ook voor in de substantia nigra van patiënten met de ziekte van Parkinson, en patiënten met de ziekte van Parkinson kunnen Lewy-lichaam dementie ontwikkelen. Sommige deskundigen denken dat de ziekte van Parkinson en Lewy-lichaam dementie deel kunnen zijn van een meer gegeneraliseerde synucleopathie die de centrale en perifere zenuwstelsels aantast. Lewy-lichamen komen soms voor bij patiënten met de ziekte van Alzheimer, en patiënten met Lewy-lichaam dementie kunnen neuritische plaques en neurofibrillaire tangles hebben. Lewy-lichaam dementie, de ziekte van Parkinson, en de ziekte van Alzheimer, overlappen behoorlijk. Verder onderzoek is nodig om de onderlinge relaties te verhelderen.
Symptomen
De initiële cognitieve achteruitgang lijkt op die van andere dementieën. Extrapiramidale symptomen treden op. Echter, in tegenstelling tot bij de ziekte van Parkinson, beginnen bij Lewy-lichaam dementie de cognitieve en extrapiramidale symptomen binnen 1 jaar van elkaar. Ook verschillen de extrapiramidale symptomen van die van de ziekte van Parkinson: Bij Lewy-lichaam dementie komt een tremor niet vroeg voor, rigiditeit van axiale spieren met instabiliteit van de loop treedt vroeg op, en tekorten neigen symmetrisch te zijn. Herhaald vallen komen veel voor.
Een fluctuerende cognitieve functie is een relatief specifiek kenmerk van Lewy-lichaam dementie. Perioden van alert, coherent, en georiënteerd zijn kunnen afwisselen met perioden van verward zijn en niet reageren op vragen, meestal gedurende een periode van dagen of weken, maar soms tijdens hetzelfde gesprek. Het geheugen is aangetast, maar de aantasting lijkt meer het gevolg te zijn van tekorten in alertheid en aandacht dan van tekorten in geheugenacquisitie; het korte-temijngeheugen wordt minder aangetast dan het cijfer span geheugen (vermogen om 7 cijfers voorwaarts en 5 cijfers achterwaarts te herhalen). Patiënten kunnen de ruimte in staren gedurende lange perioden. Overmatige slaperigheid overdag is normaal. Visuospatiële en visuoconstructionele vaardigheden (getest door Block design, tekenen van een klok, of kopiëren van figuren) worden meer aangetast dan andere cognitieve tekorten. Lewy-lichaam dementie kan moeilijk te onderscheiden zijn van delirium, en alle patiënten die deze symptomen en signalen laten zien moeten geëvalueerd worden op delirium. Visuele hallucinaties zijn normaal en vaak bedreigend, in tegenstelling tot de goedaardige hallucinaties van de ziekte van Parkinson. Auditoire, olfactorische, en tactiele hallucinaties komen minder voor. Delusies treden op bij 50 tot 65% van de patiënten en zijn vaak complex en bizar, vergeleken met de eenvoudige ideatie van achtervolging die gebruikelijk is bij de ziekte van Alzheimer.
Autonome dysfunctie is normaal, en onverklaarde syncope kan het gevolg zijn. Autonome dysfunctie kan tegelijk met of na de aanvang van de cognitieve tekorten optreden. Extreme gevoeligheid voor antipsychotica is kenmerkend. Veel patiënten hebben een rapid eye movement (REM) slaap-gedragsstoornis, een parasomnia gekenmerkt door levedige dromen zonder de gebruikelijke fysieke verlamming van skeletspieren tijdens de REM-slaap. Als gevolg daarvan kunnen dromen uitgevoerd worden, waarbij soms de bedpartner verwond wordt. Lewy-lichaam dementie progresseert; de prognose is slecht.
Diagnose
De diagnose is klinisch, maar de sensitiviteit en specificiteit zijn slecht. De diagnose wordt beschouwd als waarschijnlijk als 2 van de 3 eigenschappen—fluctuaties in cognitie, visuele hallucinaties, en parkinsonisme—aanwezig zijn en als mogelijk indien er slechts een aanwezig is. Ondersteunend bewijs bestaat uit herhaald vallen, syncope, en gevoeligheid voor antipsychotica. Overlap van de symptomen bij Lewy-lichaam dementie en de ziekte van Parkinson kan de diagnose compliceren. Wanneer de motorische tekorten (bijv. tremor, bradykinesie, rigiditeit) voorafgaan en ernstiger zijn dan de cognitieve beperking, wordt meestal de ziekte van Parkinson gediagnosticeerd. Wanneer vroege cognitieve beperking en gedragsstoornissen overheersen, wordt meestal Lewy-lichaam dementie gediagnosticeerd.
CT en MRI laten geen karakteristieke veranderingen zien maar zijn aanvankelijk nuttig bij het uitsluiten van andere oorzaken van dementie. Positronemissietomografie met fluorine-18-gelabeld deoxyglucose en single-foton emissie CT (SPECT) met 123I-FP-CIT (N-w-fluoropropyl-2b-carbomethoxy-3b-[4-iodofenyl]-tropaan), een fluoroalkyl analoog aan cocaine, kunnen helpen Lewy-lichaam dementie te identificeren maar worden niet routinematig gedaan. Voor de definitieve diagnose zijn autopsiemonsters van hersenweefsel nodig.
Behandeling
De behandeling is over het algemeen ondersteunend. Rivastigmine 1.5 mg po bid, opwaarts getitreerd zoals nodig tot 6 mg bid, kan de cognitie verbeteren. Andere cholinesteraseremmers kunnen ook nuttig zijn. Bij ongeveer ½ van de patiënten reageren extrapiramidale symptomen op antiparkinsoniaanse geneesmiddelen, maar psychiatrische symptomen kunnen verslechteren. Als dergelijke geneesmiddelen nodig zijn, heeft levodopa de voorkeur. Traditionele antipsychotica neigen, zelfs bij erg lage doses, acuut de extrapiramidale symptomen te verergeren, en kunnen dus het best vermeden worden.
4. HIV-ASSOCIATED DEMENTIE
Inleiding
HIV-geassocieerde dementie is chronische achteruitgang vanwege herseninfectie door HIV. HIV-geassocieerde dementie (AIDS dementie complex) kan voorkomen in de late stadia van HIV-infectie. In tegenstelling tot bijna alle andere vormen van dementie, heeft het de neiging op te treden bij jonge mensen. Echter, bij patiënten met een HIV-infectie kan dementie het gevolg zijn van andere infecties, zoals secundaire infectie met het JC virus, wat progressieve multifocale leukoencephalopathie veroorzaakt. Andere opportunistische infecties (bijv. fungaal, bacterieel, viraal, protozoa) kunnen ook bijdragen. Bij zuiver HIV-geassocieerde dementie, resulteren subcorticale pathologische veranderingen wanneer geïnfecteerde macrofagen of microgliacellen infiltreren in de diepe grijze stof (d.w.z. basale ganglia, thalamus), en de witte stof. De prevalentie van dementie in een laat stadium van een HIV-infectie varieert van 7 tot 27%, maar 30 tot 40% kan een mildere vorm hebben. De incidentie is omgekeerd evenredig met de CD4+-telling.
Symptomen
De symptomen en signalen kunnen vergelijkbaar zijn met die van andere dementieën. Vroege manifestaties omvatten langzamer denken en vertraagde expressie, concentratieproblemen, en afasie; het inzicht blijft bewaard, en manifestaties van depressie komen weinig voor. De motorische bewegingen zijn vertraagd; ataxie en zwakheid kunnen duidelijk aanwezig zijn. Abnormale neurologische signalen kunnen paraparese, spasticiteit van de lagere ledematen, ataxie, en extensor-plantar responses omvatten. Soms is een manie of psychose aanwezig.
Diagnose
Over het algemeen is de diagnose van dementie bij patiënten met een HIV-infectie vergelijkbaar met die van andere dementieën. Wanneer patiënten zich echter presenteren met een acute verandering van de cognitieve functie, dient de oorzaak zo snel mogelijk geïdentificeerd te worden. CT of MRI moet worden gedaan om te controleren op signalen van een CZS-infectie (bijv. toxoplasmose). MRI is nuttig dan CT omdat het andere CZS-oorzaken van dementie (bijv. progressieve multifocale leukoencephalopathie, cerebraal lymfoom) kan uitsluiten. Bevindingen in een laat stadium van HIV-dementie kunnen diffuse non-verrijkende hyperintensiteiten van de witte stof, cerebrale atrofie, en ventriculaire vergroting omvatten. Als er door neurobeeldvorming geen contra-indicatie wordt gevonden, wordt en lumbaalpunctie gedaan om een infectie uit te sluiten.
Prognose en behandeling
Patiënten met een HIV-infectie en onbehandelde dementie hebben een slechtere prognose (gemiddelde levensverwachting van 6 maanden) dan HIV-patiënten zonder dementie. De primaire behandeling is zeer actieve anti-retrovirale therapie, welke de CD4+ verhoogt en de cognitieve functie verbeterd. Ondersteunende maatregelen zijn vergelijkbaar met die van andere dementieën.
5. FRONTOTEMPORALE DEMENTIE
Inleiding
Frontotemporale dementie verwijst naar sporadische en erfelijke aandoeningen die de frontale en temporale lobben beïnvloeden, waaronder de ziekte van Pick. Frontotemporale dementie (FTD) is verantwoordelijk voor maximaal 10% van de dementieën. De leeftijd bij aanvang is meestal lager (55 tot 65 jaar) dan die bij de ziekte van Alzheimer. FTD’s treffen mannen en vrouwen ongeveer gelijk. De ziekte van Pick is een variant van FTD, welke pathologisch kan worden gekarakteriseerd door ernstige atrofie, neuronaal verlies, gliose, en aanwezigheid van abnormale neuronen (Pick-cellen) die inclusies bevatten (Pick-lichamen).
Ongeveer ½ van de FTD’s is geërfd; de meeste mutaties hebben betrekking op chromosoom 17q21-22 en resulteren in afwijkingen van het microtubuli-bindend tau-proteïne; FTD’s worden daarom beschouwd als tauopathieën. Sommige deskundigen classificeren supranucleaire palsy en corticobasale degeneratie met FTD’s omdat zij een vergelijkbare pathologie en genmutaties hebben die het tau-proteïne beïnvloeden. Bijvoorbeeld, dezelfde mutatie veroorzaakt FTD-symptomen bij het ene familielid, maar symptomen van corticobasale degeneratie bij een ander, en Pick’s-cellen kunnen afwezig zijn bij patiënten met typische symptomen van de ziekte van Pick.
Symptomen
Over het algemeen beïnvloedt FTD de persoonlijkheid, het gedrag, en meestal de taalfunctie (syntaxis en spreekvaardigheid) meer, en het geheugen minder dan de ziekte van Alzheimer doet. Het abstract denken en de aandacht (behouden en verplaatsen) worden aangetast; reacties zijn ongeorganiseerd. Oriëntatie wordt behouden, maar het terugzoeken van informatie kan aangetast zijn. De motorische vaardigheden worden gewoonlijk behouden. Patiënten hebben moeilijkheden met de volgorde van taken, hoewel visueel-spatiële en constructieve taken minder worden aangetast. Frontale release signalen (grasp, root, zuigen, snout, en palmomentale reflexen en glabella sign verschijnen laat tijdens de ziekte maar komen ook voor bij andere dementieën. Sommige patiënten ontwikkelen motorneuronziekte met gegeneraliseerde spieratrofie, zwakheid, fasciculaties, bulbaire symptomen (bijv. dysfagie, dysfonie, moeilijkheden met kauwen), en verhoogd risico op aspiratiepneumonie en vroege dood.
Frontale variant van FTD: Sociaal gedrag en de persoonlijkheid veranderen omdat de orbitobasale frontale lob wordt aangetast. Patiënten worden impulsief en verliezen hun sociale remmingen (bijv. ze kunnen aan winkeldiefstal gaan doen); ze negeren persoonlijke hygiëne. Sommigen hebben het Klüver-Bucy syndroom, dat emotionele afstomping, hypersexuele activiteit, hyperoraliteit (bijv. boulimia, zuigen en smakken met de lippen), en visuele agnosieën omvat. Impersistence (verminderde concentratie), inertie, en mentale rigiditeit verschijnen. Het gedrag wordt repetitief en gestereotypeerd (bijv. patiënten lopen elke dag naar dezelfde locatie). Patiënten kunnen willekeurige voorwerpen pakken en manipuleren zinder reden (utilisatiegedrag genoemd). De verbale output is verminderd; echolalie, preseveratie (ongepaste herhaling van een respons), en uiteindelijk mutisme treden op.
Primaire progressieve afasie: De taalfunctie verslechtert als gevolg van asymmetrische (links slechter) anterolaterale temporale lob atrofie; de hippocampus en het geheugen blijven relatief gespaard. De meeste patiënten laten problemen zien met het vinden van woorden. De aandacht (bijv. cijfer span) kan ernstig beperkt zijn. Veel patiënten hebben afasie, met verminderde spreekvaardigheid en moeilijkheden met het begrijpen van taal; aarzeling in de spraakproductie en dysarthrie zijn ook gebruikelijk. Bij sommige patiënten, is afasie het enige symptoom gedurende ≥ 10 jaar; bij anderen ontwikkelen zich globale tekorten binnen enkele jaren. Semantische dementie is een type van primaire progressieve afasie. Als de linkerzijde van het brein het zwaarst is getroffen, verliest men progressief het vermogen om woorden te begrijpen. De spraak is vloeiend maar heeft geen betekenis; een generieke of verwante term kan worden gebruikt in plaats van de specifieke naam van een object. Als de rechterzijde het zwaarst is getroffen, hebben patiënten progressieve anomie (onvermogen objecten te benoemen) en prosopagnosie (onvermogen bekende gezichten te herkennen). Ze kunnen zich geen topografische relaties herinneren. Sommige patiënten met semantische dementie hebben ook de ziekte van Alzheimer.
Diagnose
De diagnose wordt gesuggereerd door typische klinische bevindingen. Zoals bij andere dementieën, worden de cognitieve tekorten geëvalueerd. CT en MRI worden gedaan om de locatie en omvang van de hersenatrofie te bepalen en andere mogelijke oorzaken (bijv. hersentumoren, abcessen, beroerte) uit te sluiten. FTD’s worden gekarakteriseerd door ernstig atrofische, soms parierdunne gyri in de temporale en frontale lobben. Het kan echter zijn dat MRI of CT deze veranderingen niet laat zien tot in een laat stadium van FTD. FTD’s en de ziekte van Alzheimer kunnen meestal gemakkelijker gedifferentieerd worden door klinische criteria. Bijvoorbeeld, primaire progressieve afasie verschilt van de ziekte van Alzheimer in het feit dat geheugen en visuospatiële functie behouden blijven en syntaxis en spreekvaardigheid aangetast zijn.
Prognose en behandeling
FTD’s progresseren meestal geleidelijk, maar de progressiesnelheid varieert; als de symptomen beperkt blijven tot spraak en taal, kan de progressie naar algemene dementie langzamer zijn. Er is geen specifieke behandeling. De behandeling is over het algemeen ondersteunend.
6. NORMALE-DRUK HYDROCEFALIE
Inleiding
Normale-druk hydrocefalie wordt gekarakteriseerd door loopstoornissen, urinaire incontinentie, dementie, vergrote hersenventrikels, en een normale of licht verhoogde CSF-druk. Men denkt dat normale-druk hydrocefalie het gevolg is van een defect in de CSF-resorptie in arachnoïdale granulaties. Deze aandoening is verantwoordelijk voor maximaal 6% van de dementieën.
Symptomen
Meestal is de loopafwijking non-specifieke onstevigheid en een aangetast evenwicht, hoewel een magnetische loop (de voeten lijken aan de vloer te plakken) wordt beschouwd als de karakteristieke loopstoornis. Het kan zijn dat dementie zich niet voordoet tot laat in de aandoening. De meest voorkomende vroege symptomen van dementie zijn verstoringen van de uitvoerende functie en aandacht; het geheugen neigt later te worden aangetast.
Diagnose
De klassieke symptomen (loopstoornis, urinaire incontinentie, en dementie), zelfs gecombineerd, zijn non-specifiek voor normale-druk hydrocefalie, vooral bij ouderen. Bijvoorbeeld, sommige vormen van vasculaire dementie kunnen dementie, een loopafwijking, en, minder gebruikelijk, urinaire incontinentie veroorzaken. Hersenbeeldvorming kan ventriculaire vergroting laten zien disproportioneel aan corticale atrofie; deze bevinding is non-specifiek maar kan de diagnose van normale-druk hydrocefalie ondersteunen. Een lumbaalpunctie met verwijdering van 20 tot 30 mL CSF kan worden gedaan als een diagnostische proef. Verbetering van de loop, continentie, en cognitie na verwijdering helpt de diagnose te bevestigen, maar de verbetering kan onduidelijk blijven tot enkele uren na de verwijdering.
Ventriculoperitoneel shunting is nuttig bij patiënten met aanvaardbare chirurgische risico’s. Verbeteringen na de lumbaalpunctie om CSF te verwijderen, gedaan tijdens de diagnose, kunnen de reactie op shunting voorspellen. In verscheidene case series (maar niet in gerandomiseerde trials), verbeterden de patiënten aanzienlijk, meestal qua loop, continentie, en dagelijks functioneren, na shunting; verbetering in cognitie kwam minder vaak voor.
Bron
- M. Donaghy. Brain's Diseases of the Nervous System. 12th edition. Oxford University Press (USA).
- J. Biller. Practical Neurology. 3rd edition 2008. Lippincott Williams & Wilkins.
- C. Clarke, R. Howard, M. Rossor, S.D. Shorvon. Neurology: A Queen Square Handbook. 1st edition 2009. Wiley-Blackwell.


